Екосистемата се състои от два основни компонента: биотоп (конкретен
участък от местообитанието, където се срещат определните видове) и биоценоза
(всички живи обитатели). Ценоза – съвкупност от популации; популация – съвкупност
от видове. Биотопът описва самата среда с всички параметри pH, t
0
, разтворен С и
разтворен 0
2
. Биоценозата описва всички организми, които населяват биотопа. Един
организъм за да е постоянен член на дадена екосистема, нейния биотоп трябва да
изпълни неговите 4 изисквания: 1) донор на е
2) краен акцептор на е
3) източник на
Е 4) източник на С. Ако едно от тези условия не е изпълнено организма загива,
мигрира или изпада в неактивна форма. Една екосистема за да е стабилна във
времето, в нейната биоценоза трябва да присъстват представители на два типа
организми:
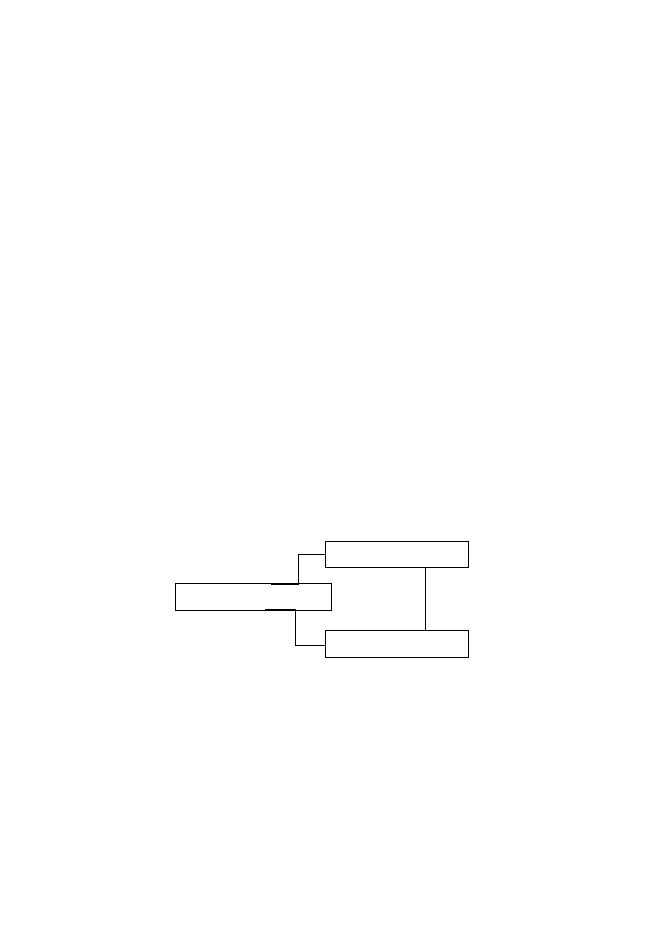
1)
Организми продуценти – те образуват първичната органика на
екосистемата за сметка на неорганичен С – СО
2
/НСО
3
→
C
n
H
n
O
n
. Като
в природата съществуват два типа продуценти: фото и хемосинтеза.
Представители – ХЛБ, висши фотосинтезиращи растения и
фототрофни бактерии. Около 90% от първичната органика е
резултат от растителна фотосинтеза от висши растения, 5% от
бактериална фотосинтеза и 5% от хемосинтеза от ХЛБ. Редукцията
на неорганичен към органичен С се осъществява от ензима
рибулозодифосфаткарбоксилаза.
2)
Организми редуценти – те преобразуват и разграждат първичната
органика на продуцентите обратно до прости неорганични
съединения. На базата на взаимоотношенията редуценти –
продуценти във всяка екосистема се извършва кръговрат на С.
Консументи са организми (хетеротрофи), които трансформират едни
органични съединения в други.
Около 90% от първичната органика е резултат от растителна фотосинтеза от
висши растения. Около 5% е резултат от бактериална фотосинтеза и 5% на
хемосинтеза от ХЛБ.
Мобилният фонд на елементите участва в трансформациите на елемента, по
малък е, но е поактивен. Резервният фонд се състои от неподвижни елементи. При
определени обстоятелства (когато е нужен) може да има преминаване на единия към
другия. Основна част от резервният фонд са седименти.
Трофичните вериги продуцират биомаса. Трофичните вериги показват
връзката между отделните групи организми в зависимост от начинът им на хранене.
Всеки преход от едно трофично ниво към друго е свързан със загуба на Е и колкото
подълга е дадена трофична верига, толкова поголеми са загубите на Е. За това те
обикновенно са къси 46 звена.
Закон на минимума на Либих – при постоянни условия, ограничаващо действие
за развитието на даден организъм ще има този фактор или вещество близки до
Органични
съединения
Органични
съединения
Неорганични
съединения
Редуценти
Редуценти
Консумент
и
Продуценти
необходимия минимум, т.е. фактора който е в недостиг лимитира. Закон на Шелфорд
за толерантността – невъзможността за развитие на даден организъм може да се
определи както от недостига, така и от излишък на даден фактор на средата.
Предмет на екологията – изучава връзките между живите организми и
обкръжаващата ги среда. Скоростите на биологичните процеси не са постоянна
величина, а са силно зависими от параметрите на средата. Върху МО найсилно
влияние оказват параметрите t
0
и p. Параметърът, при който стойността на скоростта
на процеса е найголяма имаме оптимална скорост. Двете крайни точки на кривата са
съответно минимум и максимум и там скоростите на процеса са близки до 0, като при
тези нива МО са все още живи и при подходящи промени могат да се развият.
Границата между минимума и максимума се нарича граница или праг на
съществуване на съответния вид. Ако условията се променят извън прагът на
съществуване пред вида има 3 варианта: да мигрира, загива или изпада в неактивна
форма. Екологичната ниша е комбинация от стойностите на факторите на средата, в
която съществува дадения МО. Три типа кръговрати: газообразен, утаечен и смесен.
Биогенни елементи: C, H, O, N, Fe, S, P,Mg. Периодично култивиране: лаг фаза
(адаптивна, синтезират се ензими), експоненциална фаза (максимална скорост на
растеж), стационарна фаза (броя на новоразвилите се и на умрелите клетки е равен)
и фаза на отмиране (броя на новоразвилите се е < от броя на умрелите, натрупани са
много токсични вещества). Сукцесия – последователна подмяна на популациите.
Примерно в едно пиритно находище, първо се подготвят условият за развитие на
окисляващите МО.
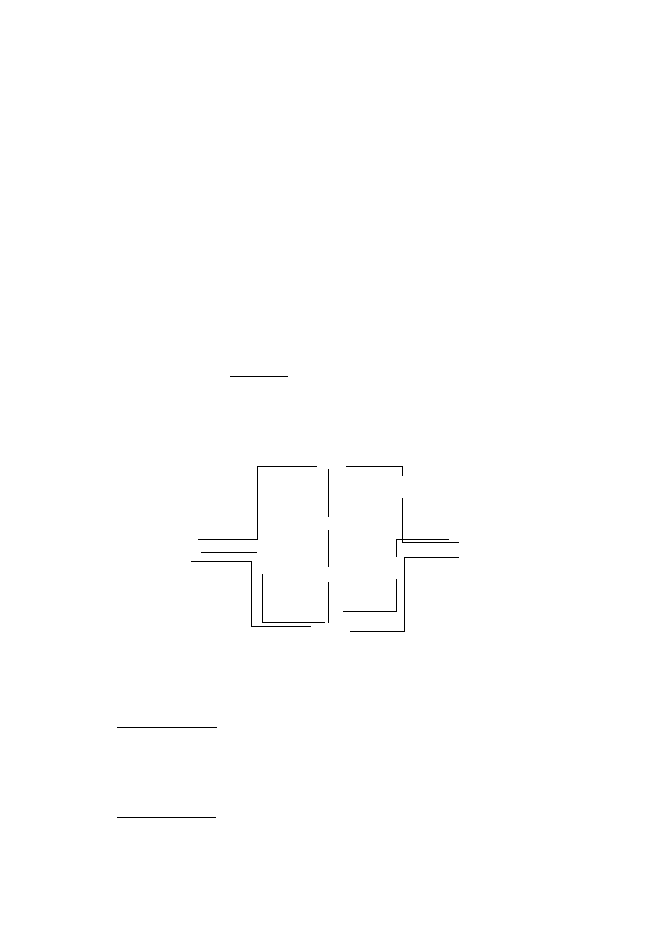
Кръговрат на N
1Амонификация; 2, 3 Нитрификация; 4 Асимилативна редукция на нитрати; 5,6 –
Дисимилативна редукция; 7 Фиксация на N
2
В органиката N е 1214% от цялата маса?, т.е. е голяма част, главна съставна
част на белтъците. Найчестата органична форма на N е NH
2
(амино група).
Амонификацията е разграждане на органиката и се продуцира NH
3
(CH
4
N
2
O+H
2
O 2
→
NH
3
+CO
2
). Тя протича и в аеробна и в анаеробна среда. Пълна
минерализация на органиката съдържаща азот протича в аеробна среда.
Амонифициращи бактерии са р. Clostridium, Pseudomonas и Vibrio, които са
хетеротрофи, неутрофили. Поголяма част от амонякът на планетата е биологично
генериран. NH
4
+
(амоний) е ценен и лесно усвояем източник на N.
Нитрификацията се осъществява от ХЛБ (автотрофи), които се делят на две
групи: 1) окисляват NH
3
→
NO
2
(2NH
3
+3O
2
2
→
HNO
2
+2H
2
O + E) 2) окисляват NO
2
→
NO
3
N
орг
NH
4
+
NO
3
N
2
NO
2
NH
3
(NH
4
+
)
1
3
2
4
5
6
7

(2HNO
2
+O
2
2
→
HNO
3
+E) . Наименованията на МО от първата група започват с нитрозо
(Nitrosomonas, Nitrosococcus), а на втората с нитро(Nitrobacter, Nitrococcus).
Нитрификацията е задължително аеробен процес. Двете групи са свързани
симбиотично. Окислението води до отделяне на Е, която МО ползват. Бактериите от
първата група снабдяват с материал бактериите от втората. NO
2
е силно токсичен.
Бактериите от втората група понижават токсичността на системата. Така те колкото
повече нитрит (NO
2
) преработват, толкова повече NO
2
се получава от амоняк, т.е се
засилва действието на първите бактерии. NO
3
и NO
2
са лесно услвояеми форми на
азот. 2 вида денитрификация – асимилативна и дисимилативна.
При асимилативната редукция на нитрат се получава биомаса. Процесът на
усвояване на NO
3
е количествено ограничен и при големи количества (преторяване)
се натрупва азот в растенията, който не е усвоен и превърнат в органични
съединения.
Дисимилативна редукция на NO
3
: N
5+
O
3
N
→
3+
O
2
N
→
2+
O N
→
2
O N
→
2
. При
дисимилативната редукция няма биологично усвояване на N, a N остава във
външната среда. Денитрификацията е процес на превръщане на токсични и
разтворими форми на N до напълно безвреден N. Дисимилативната редукция е
нитратно дишане на МО. Извършва се денитрифициращи бактерии, факултативни
анаероби (устойчиви към наличие на О
2
). Поголяма част са хетеротрофи.
Acidithiobacillus denitrificans – окислява H
2
S S
→
0
и е
от това окисление отиват за
редукцията на NO
3
N
→
2
, а източник на С е СО
2
. Други представители на
денитрифициращите бактерии са от родовете Bacillus, Pseudomonas, Alcaligenis,
Micrococcus, Proteus.
Фиксация (усвояване на атмосферен азот) на N
2
– N
2
NH
→
4
+
N
→
орг.
. Резервният
фонд на N е N
2
(намиращия се в атмосферата молекулен азот) и така резервния фонд
се превръща в мобилен. Симбионтно съжителство между бобови растения и бактерии
от род Rhizobium, като бактериите вземат от растенията Е и така фиксират
намиращия се в атмосферата азот и го прехвърлят към почвата – азотфиксация.
Може и от свободно живеещи МО – Azotobacter – аероб; Clostridium.
Нитрификацията участва в пречистването на води, примерно в канализации,
където се натрупват нежелани количества амоняк, образуван в резултат от
разлагането на органика. Чрез денитрификация се премахва нитрати и нитрити от
води, чиито концентрации могат да доведат до побурно развитие на водорасли,
което води до побързо изчерпване на О
2
във водата. За селското стопанство
денитрификацията е вреден процес, защото изнася азот. NaNO
3
– чилска и KNO
3
–
обикновенна селитра. Карбамид = уреа = CH
2
N
2
О.
Кръговрат на Р
Утайки ІІ
тип
Разтворими
фосфати
Асимилаци
я
Р
ор
г.
М
О
Р – скали
гуано
Утайки І тип
Водоплаващи
птици
ерози
я

Фосфорът е биогенен елемент, важна съставка на ДНК. При излишък от Р
има бурно развитие на растенията, което води до увеличаване на броя на МО, които
се хранят с биомаса. Те са аероби и консумират О
2
, следователно количеството на О
2
в системата намалява.
При кисело рН фосфора е под форма на H
2
PO
4
, при неутрално HPO
4
2
, а при
основно PO
4
3
(фосфатен йон). При определени условия фосфатите се утаяват.
Утайки І тип са плиткодънни утайки. Утайки ІІ тип са дълбоководни утайки. Чрез
ацидолизис се действа върху фосфорни минерали, които се разграждат. Протонната
атака (Н
+
) е от минерални киселини. Фосфорни минерали са: апатити, фосфорити.
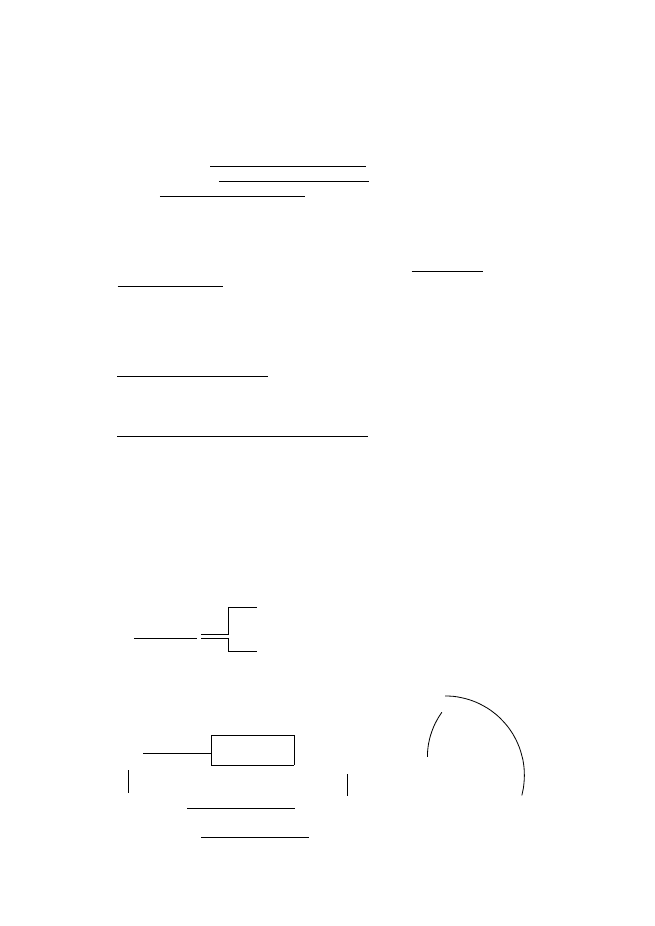
Кръговрат на S
1минерализация на серни органични съединения (десулфуризация??); 2, 3 –
окислителни трансформации; 4 асимилативна редукция; 5 – МДСР (сулфатно
дишане)
Разграждането на органични
S
съединения се извършва от редуценти.
Органичната S се минерализира до сулфид (S
2
). Този процес може да протече в
аеробни и в анаеробни условия. Извършва се хетеротрофни МО от родовете Bacillus,
Proteus, Pseudomonas.
Сулфидите (FeS
2
, CuFeS
2
, ZnS, PbS, FeAsS и др.) са неразтворими във вода.
След като се окислят от МО се получава SO
4
2
, който е усвояемата/водноразтворима
форма на S + окислислението е екзотермичен процес и МО ползват отделената Е за
синтез на органика. Пряк механизъм на окисление – ХЛБ и О
2
–
4FeS
2
+2H
2
O 2
→
Fe
2
(SO
4
)
3
+2H
2
SO
4
; 4CuFeS
2
+2H
2
SO
4
4CuSO
→
4
+2Fe
2
(SO
4
)
3
+2H
2
O.
Прекият механизът може да се разглежда като комплексна биоелектрохимична
окислителна система, обхващаща окисляемия минерал и бактериите прикрепени към
повърхността му. Тази система пренася е
(отнемат се е
от външния слой чрез
ензимни системи) от анодната област на минерала към компонент от бактериалната
дихателна верига, която представлява катод. Пренася се е
от външният слой към О
2
,
който е акцептор. Kосвен механизъм на окисление – Fe
3+
образувани при бактериално
окисление на Fe
2+
2FeS
2
+2Fe
2
(SO
4
)
3
6
→
FeSO
4
+4S
0
;
CuFeS
2
+2Fe
2
(SO
4
)
3
→
CuSO
4
+5FeSO
4
+2S
0
. При косвеният мехнанизъм МО регенерират
Fe
3+
. И прекият и косвения механизъм действат едновременно, но приноса им към
окислителната атака може да е различен и се определя от особеностите на
минерала, вида на бактериите и условията в околната среда. Сулфидите, които са по
добре представени в дадена скала се атакуват преимуществено от ХЛБ. Само че
SO
4
2
S
0
S
2
S
орг.
1
2
3
4
5
някои сулфиди са поустойчиви и за това МО ги пропускат. Сулфидните минерали се
окисляват от бактерии, които могат да окисляват и желязо и сяра. Бактериите, които
окисляват сярата без да ползват тази Е го правят за да достигнат до усвояема форма
на сярата. Окислението на S
2
се извършва от ХЛБ:
Мезофили – оптимална температура 3035
0
С; облигатни автотрофи;
представители: Acidithiobacillus ferrooxidans (донор на е
: FeS
2
, Fe
2+
, MS, S
0
, S
2
O
3
2
, S
4
O
6
2
, UO
2
); Acidithiobacillus thiooxidans (S
0
SO
→
4
2
, донор на е
S
0
, S
2
O
3
2
,
S
4
O
6
2
); Leptospirillum ferrooxidans (не може да окислява S, така при окисление
на FeS
2
се натрупва S
0
и за това участва в смесени култури с тионови
бактерии; при рН<1,5 L.f. преобладава в смесените култури, а при рН>2
преобладава A.f.) Leptospirillum ferriphillum
Умерени термофили – оптимална температура 5055
0
С; факултативни
автотрофи; представители: Acidithiobacillus caldus; Sulfobacillus
thermosulfooxidans (донор на е
Fe
2+
,S
0
, Sсъед без FeS
2
).
Екстремални термофили – оптимална температура 6575
0
С; представители:
Sulfolobus metallicus (донор на е
е S
0
); Acidianus breierley; Sulfococcus spp.
Фотофосфорни серни барктерии – окисляват разтворени неорганични серни
съединения. Скоростите на окисление на хетеро и фототрофи са много пониски от
тези на ХЛБ.
Асимилативната редукция на SO
4
2
е процесът на усвояването им от
организмите и превръщането им в органична форма. От окислена се преминава в
редуцирана форма.
Thiobacillus thioparrus – среща се в почви и води. Thiobacillus denitrificans H
2
S S
→
0
Микробна дисимилативна сулфат редукция – SO
4
2
S
→
2
, т.е. 2CH
2
O + SO
4
2
→
H
2
S + 2HCO
3
Органиката е донор на е
, а SO
4
2
е акцептор на е
. МДСР е анаеробен процес, има
алкализиращо действие заради отделянето на HCO
3
, а редуцираната форма на SO
4
2
е точно определена H
2
S. СРБ в голяма част са хетеротрофи. СРБ са анаероби, но са
толерантни към О
2
. МДСР = анаеробно сулфатно дишане.
S
2
O
3
2
тиосулфат; SO
3
2
сулфит. Отделените при окислението на FeS
2
Fe
3+
окисляват още FeS
2
и така в системата остават токсичните Fe
2+
.
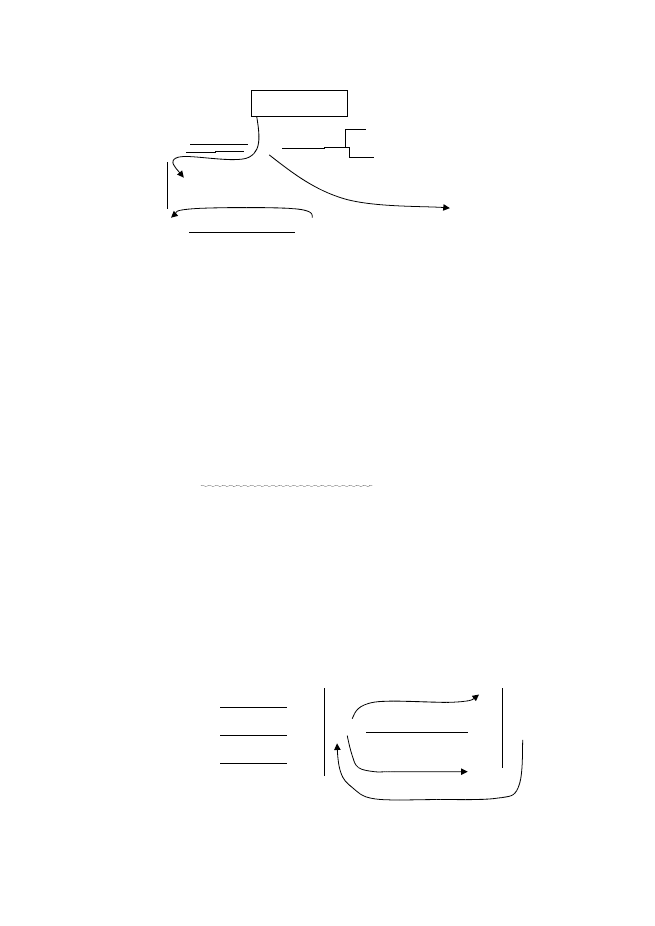
Кръговрат на Fe
Fe
0
Fe
2+
,
Fe
2+
компл.
pH 5,5 – 8 Fe
2+
корози
Fe
2+
[Fe(OH)
2
] – аеробна корозия (ацидолизис)
Fe
2+
[Fe(OH)
2
; FeS] – анаеробна среда с участие
Асимилаци
я
Хет.М
Fe
3+
ЖОБ
FeOOH
Fe(OH)
3
Fe
2
O
3
Fe
3
O
4
Хет.М.
+ C
орг
Fe
2+
ЖОБ, C
Fe
3+
рН < 4 FeS
2
Fe е един от найразпространение елементи в природата. Биогенен елемент.
Fe е един от 6те елемента, които поддържат ХЛБ метаболизъм т.е тези МО живеят
за сметка на отделената при това окисление Е. Fe има висока концентрация в
биомасата (цитофроми, цитохромни оксидази прехвърлят е
и има редукция Fe
3+
→
Fe
2+
). Fe
3+
е силен окислител (той приема е
и се редуцира, Fe
3+
е поефикасен
окислител от О
2
), разтворим само при рН <3,5. При рН>3,5 Fe
3+
хидролизира. Някои
органични съединения при такива условия формират Fe
3+
комплекси. Fe
2+
е редуктор
(той отдава е
и се окислява), разтваря в поширок интервал на рН, добре разтворимо
е, източник е на Е за определени ХЛБ (ацидофилни). При кисело рН не се окислява от
О
2
. При рН>4,55 имаме химично окисление на Fe
2+
от О
2
, но процесът се извършва с
ниска скорост, която се засилва при неутрално и алкално рН. При окислението на
FeS
2
се получават 2 продукта – Fe
3+
, който е силен окислител + H
2
SO
4
, която води до
понижаване на рН. Ацидофилни ХЛБ окисляващи Fe
2+
: Sulfolobus metalicus. Желязо
окисляващите бактерии (ЖОБ) не използват химичната енергия от окислението на
Fe
2+
като източник на Е, а окисляват Fe
2+
с цел да се премахне и го утаяват под
формата на Fe(OH)
3
. Анаеробно желязно дишане?
. Ярозити хFe
3
(SO
4
)
2
(OH)
6
, където
Х може да бъде – K
+
, Na
+
, NH
4
+
, H
3
O
+
. Те са порьозни, могат да задържат бактерии и
се ползват за биофилми, падат като утайка при рН 1,9. Образуват се от хидролиза на
ферисулфат: 3Fe
2
(SO
4
)
3
+14H
2
O
→
2(H
3
0)Fe
3
(SO
4
)
2
(OH)
6
. Fe
3+
= Fe
2
(SO
4
)
3
– ферисулфат.
Валентност на желязото в пирита 2+. Fe
2+
е разтворимата/токсична форма. МО които
окисляват Fe
2+
при неутрално рН – Gallionella; Leptothrix (ЖОБ), а при кисело рН – A.f.;
L.f. Химичното утаяване на Fe
2+
от руднични води, с вар, се предпочита при бързо
течаща вода и при висока киселинност и замърсеност на водата. Утаяването е
ефикасен начин за премахване на замърсявания с Fe. ЖОБ – хетеротрофи,
действащи с прекисен механизъм, при слабо кисело и неутрално рН?
Кръговрат на Mn
Fe
2+
ХЛБ,O
Fe
3+
+Н
2
О
Fe(OH)
3
– колоидна
субстанция, при рН>3
xFe
3
(OH)
6
(SO
4
)
2
–
ярозити, при рН<3
Fe
3+
+
СРБ + С
орг.
=
H
2
S
Fe
Fe
2+
ред.бак
т.
Fe
2+
ХЛБ,
pH 6
8
pH 6
8
Mn
2+
Mn
2+
Mn
2+
Mn
4+
Mn
4+
Mn
4+
Mn
2+
Mn
2+
Mn
2+
Mn
4+
Mn
2+
хет.м. І
хет.м. ІІ
хим.окисл
.
ензимна
ред.
неензимна
ред.
хим.
редукция
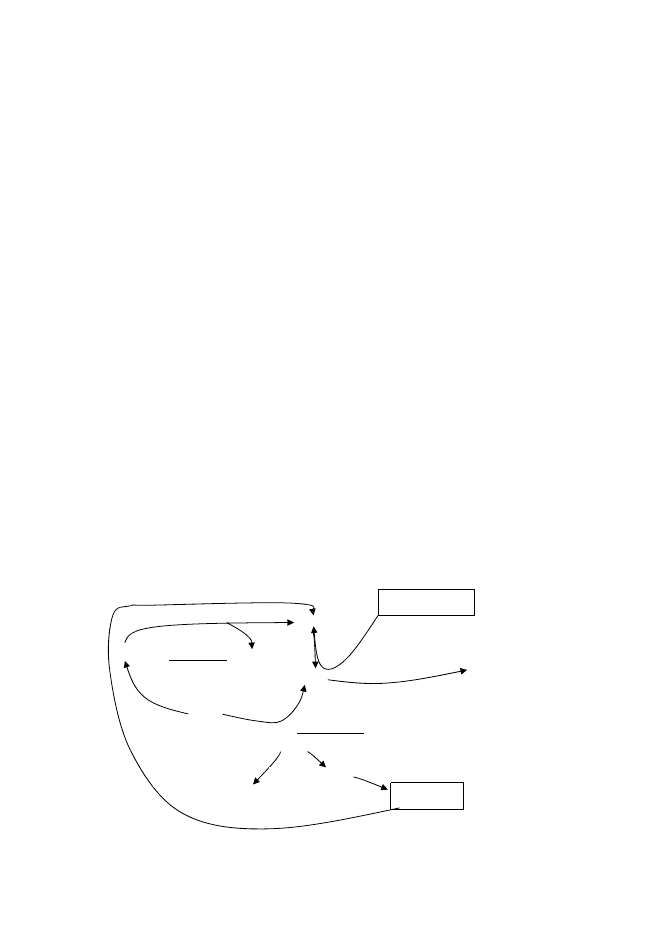
Mn е тежък метал, вторият по разпространение след Fe. Токсичен в само във
водоразтворими форми т.е. биологично усвояемите форми на елемента. Токсичността
се определя от концентрацията и от това под каква форма се намира елемента.
Приема се че при пониско рН елементите са поразтвроими. Mn се разтваря много
добре във води. Mn
2+
е разтворим, трудно хидролизира. За да се утаи като хидроокис
трябва да се повиши много рН на средата (10+), при рН 78 той е подвижен. Полесно
е да се окисли Mn
2+
→
Mn
4+
и той пада като утайка от MnO
2
(неразтворима, лесно
можеда се отдели). Някои МО при рН ~ 6 окисляват Mn
2+
до MnO
2
(това е стабилна
форма). Голяма част от МО окисляващи Mn
2+
са хетеротрофи. При това окисление се
отделя Е т.е. процесът е екзогенен. При окислието на Mn
2+
до Mn
4+
се намалява
токсичният му ефект. Бактериалното окисление се извършва от генерирани от МО
прекиси (Н
2
О
2
). Прекисът също е токсичен и ако остане в излишък той започва да
пречи. Ензимът каталаза го разгражда до Н
2
О и О
2
. Окислението само от О
2
става
само в поалкална среда и протича с пониска скорост. О
2
е естествен окислител, но
при рН>8,5. Mn
4+
е активен окислител. Ензимна редукция – Mn анаеробно дишане
ензимите отнемат е
от органични съединения и ги прехвърлят към Mn
4+
, който се
редуцира до Mn
2+
. При неензимната редукция Н
2
S редуцира Mn
4+
, а Н
2
S идва от СРБ,
т.е. чрез секретирани метаболити от МО. Ако в средата има Fe
2+
това пречи на
окислението, защото при наличие на Fe
2+
, Mn
4+
ги окислява до Fe
3+
, а Mn се редуцира
до Mn
2+
. И така за да може да се окисли мангана първо с ацидофилни бактерии се
окислява Fe
2+
до Fe
3+
. При Mn минерали съдържащи Mn
2+
добиването става с
ацидолизис, а при тези съдържащи Mn
4+
трябва редукция с МО. Mn се отстранява с
БС и БА. БА и БС се използват и за пречистване и за добив на Mn. Mn окисляващи МО
– Leptothrix, Siderocystes, Metallogenum. За чистене се използват: имобилизация
(утаяване при рН>8,5 като MnO
2
) и мобилизация (редуциране на Mn
4+
до Mn
2+
като
преминава от утаено в течно състояние). Mn
2+
може да пада и като карбонат под
формата на MnCO
3
. MnS
2
– ханерит.
Силно токсични елементи: Hg, As, Se, Ti, Zn, Cd, Pb. Послабо токсични: Co, Ni,
Mo, Cu, Cr. Найслабо токсични: Ba, V, Mg, Al, Sr.
Кръговрат на Zn
Fe
2
(SO
4
)
3
FeSO
4
ХЛ
Б
Zn
S
ZnS
O
4
СРБ + С
орг.
=
H
2
S
ZnO
ZnCO
3
H
2
S
O
4
ХЛБ,О
2
х
л
б
Zn(ОН
)
2
+Н
2
О
рН >
6,5
ZnCl
2
ZnCl
4
2
+H
Cl
Хет.
С
орг.
Биосфер
а
Zn
компл.
Хет.
FeS
2

При повишена концентрация на подвижната му форма е токсичен, но е най
слабо токсичен от металите. Микроелемент.
Ацидолизис на ZnO и ZnCO
3
(HCl) последван и от комплексолизис.
Дисимилативна сулфат редукция – H
2
S
атакува ZnSO
4
и го утаява като ZnS.
Окислителна сярнокисела деструкция – образува се S
0
, която се отлага върху
повърхността и пасивира. Бактерии окисляват S
0
до H
2
SO
4
като по този начин се
открива нова повърхност и киселината спомага окислението на ZnS. Окислението на
ZnS до ZnSO
4
става по пряк и косвен механизъм. H
2
SO
4
химически разтваря ZnO и
ZnCO
3
и се получава ZnSO
4
. Цинк се чисти и с БА и БС. Може и с МДСР при рН>6,5 –
ZnSO
4
→
ZnS. ZnCO
3
– смитсонит.
Кръговрат на U
2S
2
UO
2
+ 2Fe
3+
U е радиоактивен елемент, има два изотопа – 238 (99,2%) и 235 (0,72%) и
поддържа хемолитотрофен метаболизъм, но не е биогенен елемент. Среща се под
формата на U
4+
и U
6+
, като U
4+
е слабо разтворим дори в много кисели разтвори.
Докато U
6+
под формата на UO
2
SO
4
2
(уранилсулфат) е много добре разтворим при
различни стойности на рН, найвече в кисело. Урановите руди са в асоциации със
сулфидни минерали (найвече FeS
2
). В киселите находища H
2
SO
4
разтваря добре U
6+
до UO
2
SO
4
2
(уранилсулфат), а U
4+
за да се разтвори първо трябва да се окисли до
U
6+
. Това се прави от бактерии – A. ferrooxidans, чрез пряко бактериално окисление и
имаме UO
2
UO
→
2
2+
(ХЛБ), като тази реакция е независима от Fe
3+
. Чрез сорбентни
смоли се хваща U. В киселите находища има пряко и косвен окисление на U. При
алкална среда т.е. преобладават CO
3
2
, окислението става пак биологично от
хетеротрофни МО чрез генериране на прекис, който окислява U до UO
2
CO
3
. UO
2
CO
3
(уранилкарбонат) е добре разтворим при алкално рН. В алкалните находища U се
извлича по химичен път, защото в тези условия няма много органика в средата, която
е нужна за развитието на МО извършващи окислението. UO
2
CO
3
се разлага/окислява
чрез прекисен механизъм. Алкалното окисление се ползва за пречистване на почви,
защото там има достатъчно органика. Химическото чистене става с хидроокисине с
карбонати, при алкална среда по реакцията UO
2
+ Ca(OH)
2
UO
→
2
(OH)
2
. Чрез МДСР
имаме пряка редукция на урана U
6+
→
U
4+
и урана се утаява под формата на UO
2
(уранинит). Уран се чисти с БА и БС (FeOOH).
Кръговрат на As
рН ~ 7
2SO
4
2
ср
б
2H
2
S
O
4
хлб
UO
2
SO
4
2
срб
UO
2
UO
2
2+
+
2Fe
2+
хлб; хим.
UO
2
CO
3
U
O
2
хет.м.о
UO
2
2
+
+СО
3
2
Биосфе
ра
As
3
хет.мо
As
5
H
2
асимилаци
As
2
S
As
2
S
Срб +
Казус по арт педагогика
Примерни варианти на справяне със житейски и психологични проблеми на 12-годишно момиче, което губи на крехка възраст любим и важен в живота ѝ човек...Казус по арт педагогика
| Предмет: | Педагогика |
| Тип: | Казуси |
| Брой страници: | 6 |
| Брой думи: | 1010 |
| Брой символи: | 5161 |